Senin, 02 September 2013
Atom
ATOM DAN STRUKTUR ATOM
- A. PENDAHULUAN
| D |
Dari sekian banyak unsur yang ada, tentu orang akan mengalami kesulitan bila mempelajari sifat-sifat unsur tersebut. Untuk memudahkan, maka beberapa ahli mengelompokkan unsur-unsur tersebut. Pertama-tama dilakukan pengelompokan secara sederhana yaitu berdasarkan sifat kelogaman, selanjutnya pengelompokan berdasarkan kenaikan massa atomnya. Pengelompokan tersebut ternyata terdapat banyak kelemahan, akhirnya pengelompokan unsur-unsur dilakukan berdasarkan kenaikan nomor atom. Pengelompokan ini merupakan suatu kemajuan yang pesat, karena dapat mengkaitkan dengan sifat kimia, sifat fisika, dan massa unsur sekalipun masih terdapat sedikit kelemahan.
PERKEMBANGAN MODEL ATOM
- 1. Model Atom Dalton
Pada tahun 1808, John Dalton seorang ahli kimia bangsa Inggris mengemukakan gagasannya tentang atom sebagai partikel penyusun materi. Menurut teori atom Dalton:
- Atom merupakan partikel terkecil yang tidak dapat dibagi lagi.
- Atom suatu unsur yang sama mempunyai bobot yang sama, sedang unsur yang berbeda atomnya akan berbeda pula, yang berarti mempunyai bobot berbeda.
- Senyawa dikatakan sebagai hasil dari penggabungan atom-atom yang tidak sama dengan perbandingan bobot yang proporsional dengan bobot atom yang bergabung itu.
- Reaksi kimia hanya melibatkan penataulangan atom-atom sehingga tidak ada atom yang berubah akibat reaksi kimia.
- 2. Model Atom Thomson
- 3. Model Atom Rutherford dan Kelemahannya
- Sebagian besar atom berupa ruang kosong, sehingga semua massa atom terpusat pada inti atom yang sangat kecil.
- Atom disusun dari :
- Inti atom yang bermuatan positip.
- Elektron-elektron yang bermuatan negatif yang mengelilingi inti atom.
- Seluruh proton terpusat di dalam inti atom.
- Banyaknya proton di dalam inti sama dengan jumlah elektron yang mengelilingi inti atom, sehingga atom bersifat netral.
Satu keberatan dari postulat Rutherford adalah selama elektron bergerak dalam suatu orbit, maka ada percepatan menuju ke pusat, elektron ini secara kontinyu mengemisikan radiasi dan secara berangsur-angsur akan melepaskan energi yang akhirnya akan jatuh ke dalam inti.
Hal ini adalah tidak mungkin terjadi karena atom itu stabil lagi pula model ini tidak dapat memperoleh data dari penelitian spektrum atom unsur-unsur.
- 4. Model Atom Bohr
Postulat Bohr berbunyi:
- Elektron dalam suatu atom bergerak mengitari sekeliling inti pada orbit tertentu. Setiap orbit mempunyai tingkat energi tertentu dan energi suatu elektron adalah tetap selama berada pada orbitnya. Elektron yang berada pada tingkat ini disebut tingkat stasioner dan setiap tingkat energi dinamakan tingkat energi atau kulit. Elektron pada tingkat energi ini tidak meradiasikan energi.
- Emisi dan absorpsi energi dalam bentuk radiasi hanya dapat dihasilkan jika suatu elektron pindah dari tingkat stasioner ke tingkat lainnya.
- Energi tidak diemisikan atau diabsorpsi secara pelan-pelan, tetapi dalam satuan/paket h.u (disebut kuantum), dengan h adalah tetapan Planck dan u adalah frekuensi energi yang diradiasikan.
- Lebih jauh tingkat energi dari inti, maka lebih besar pula energinya. Energi diabsorpsi bila elektron melompat dari orbit bagian dalam ke orbit yang lebih luar. Energi akan diemisikan bila elektron bergerak dari orbit yang luar ke orbit yang lebih dalam. Besarnya kuantum yang diemisikan atau diabsorpsikan dapat ditentukan dari tingkat energi elektron mula-mula dan tingkat akhir setelah mencapai keadaan stasioner. Bila E2 dan E1 masing-masing adalah tingkat energi awal dan akhir, sedang ? adalah frekuensi maka :
- å E = E1 – E2 = h.u
- Energi yang ada pada setiap orbit dipengaruhi oleh kondisi di mana momentum anguler (m.u.r) elektron yang bergerak dalam orbitnya mempunyai nilai tertentu yang secara sederhana merupakan kelipatan dari h/2u. Dengan m = massa elektron, u = kecepatan, r = jari-jari orbit, h = tetapan Planck, dan n = orbit yang ditempati elektron (1, 2, 3, …… atau sesuai huruf K, L, M, … …. ).
- 5. Model Atom Mekanika Gelombang
Dengan alasan ini lintasan elektron yang digambarkan Bohr tidak mungkin ada. Yang dapat dikatakan adalah elektron dalam atom mempunyai kebolehjadian ditemukan dalam ruang-ruang tertentu dalam atom yang disebut orbital. Gagasan bahwa elektron berada dalam orbital-orbital di seputar inti atom merupakan model atom yang mutakhir.
Pada tahun 1926, Erwin Schrodinger seorang ahli fisika Austria pemenang hadiah nobel untuk bidang fisika tahun 1933, berhasil merumuskan persamaan gelombang untuk menggambarkan gerakan elektron dalam atom. Energi dan bangun ruang orbital-orbital sebagaimana yang telah kita pelajari, diturunkan berdasarkan perhitungan dengan menggunakan persamaan gelombang Schrodinger.
RANGKUMAN
v Menurut teori atom Dalton :
- Atom merupakan partikel terkecil yang tidak dapat dibagi lagi.
- Atom suatu unsur yang sama mempunyai bobot yang sama, sedang unsur yang berbeda atomnya akan berbeda pula, yang berarti mempunyai bobot berbeda.
- Senyawa dikatakan sebagai hasil dari penggabungan atom-atom yang tidak sama dengan perbandingan bobot yang proporsional dengan bobot atom yang bergabung itu.
- Reaksi kimia hanya melibatkan penataulangan atom-atom sehingga tidak ada atom yang berubah akibat reaksi kimia.
v Teori atom Rutherford:
- Atom disusun dari :
- Inti atom yang bermuatan positip.
- Elektron-elektron yang bermuatan negatif yang mengelilingi inti atom.
- Dalam atom yang netral, banyaknya inti atom yang bermuatan positip sama dengan banyaknya elektron.
- Elektron dalam suatu atom bergerak mengitari sekeliling inti pada orbit/tingkat energi tertentu.
- Lebih jauh tingkat energi dari inti, maka lebih besar pula energinya.
- Energi akan diemisikan bila elektron bergerak dari tingkat energi tinggi ke tingkat energi yang lebih rendah.
- Energi akan diabsorpsi bila elektron bergerak dari tingkat energi rendah ke tingkat energi yang lebih tinggi.
- Energi tidak diemisikan atau diabsorpsi secara pelan-pelan, tetapi dalam satuan/paket h? (disebut kuantum).
- Bahwa elektron dalam atom sebagai partikel dan gelombang.
- Heisenberg mengemukakan azas ketidakpastian, yakni tidak mungkin mengetahui secara bersamaan kedudukan dan kecepatan gerak elektron.
- c. Jadi elektron dalam atom mempunyai kebolehjadian ditemukan dalam ruang-ruang tertentu dalam atom yang disebut orbital.
Siklus Menstruasi
Umumnya siklus menstruasi terjadi secara periodik setiap 28 hari (ada pula setiap 21 hari dan 30 hari) yaitu sebagai berikut : Pada hari 1 sampai hari ke-14 terjadi pertumbuhan dan perkembangan folikel primer yang dirangsang oleh hormon FSH. Pada saat tersebut sel oosit primer akan membelah dan menghasilkan ovum yang haploid. Saat folikel berkembang menjadi folikel de Graaf yang masak, folikel ini juga menghasilkan hormon estrogen yang merangsang keluarnya LH dari hipofisis. Estrogen yang keluar berfungsi merangsang perbaikan dinding uterus yaitu endometrium yang habis terkelupas waktu menstruasi, selain itu estrogen menghambat pembentukan FSH dan memerintahkan hipofisis menghasilkan LH yang berfungsi merangsang folikel de Graaf yang masak untuk mengadakan ovulasi yang terjadi pada hari ke-14, waktu di sekitar terjadinya ovulasi disebut fase estrus.
Selain itu, LH merangsang folikel yang telah kosong untuk berubah menjadi badan kuning (Corpus Luteum).
Badan kuning menghasilkan hormon progesteron yang berfungsi mempertebal
lapisan endometrium yang kaya dengan pembuluh darah untuk mempersiapkan
datangnya embrio. Periode ini disebut fase luteal,
selain itu progesteron juga berfungsi menghambat pembentukan FSH dan LH,
akibatnya korpus luteum mengecil dan menghilang, pembentukan
progesteron berhenti sehingga pemberian nutrisi kepada endometriam
terhenti, endometrium menjadi mengering dan selanjutnya akan terkelupas
dan terjadilah perdarahan (menstruasi) pada hari ke-28. Fase ini disebut
fase perdarahan atau fase menstruasi. Oleh karena tidak ada progesteron, maka FSH mulai terbentuk lagi dan terjadilan proses oogenesis kembali.
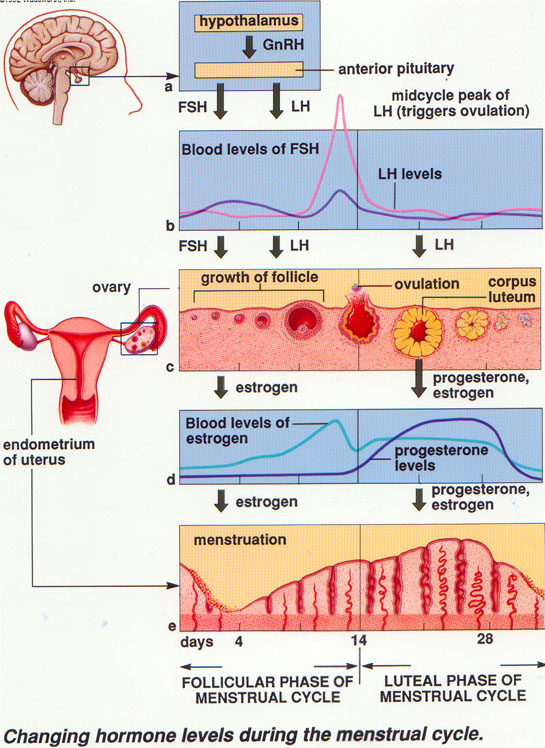
Gambar 1. Siklus Menstruasi
Siklus mentruasi ini melibatkan kompleks hipotalamus-hipofisis-ovarium.
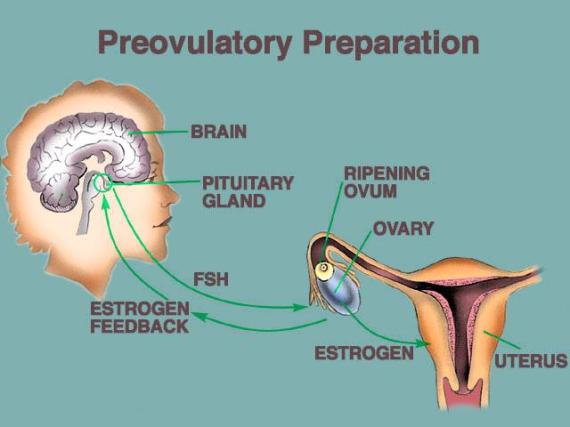
Gambar 2. Kompleks Hipotalamus-Hipofisis-Ovarium
Sistem hormonal yang mempengaruhi siklus menstruasi adalah:
1. FSH-RH (follicle stimulating hormone releasing hormone) yang dikeluarkan hipotalamus untuk merangsang hipofisis mengeluarkan FSH
2. LH-RH (luteinizing hormone releasing hormone) yang dikeluarkan hipotalamus untuk merangsang hipofisis mengeluarkan LH
3. PIH (prolactine inhibiting hormone) yang menghambat hipofisis untuk mengeluarkan prolaktin
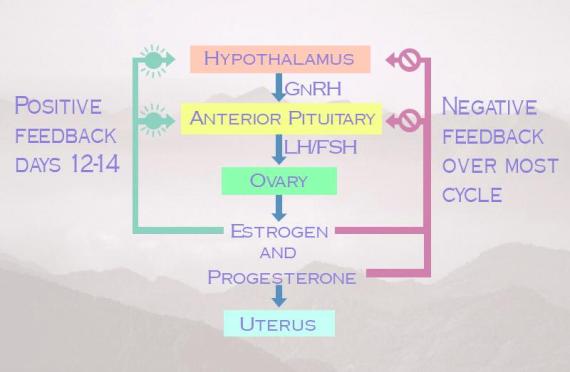 Gambar 3. Siklus Hormonal
Gambar 3. Siklus Hormonal
Pada tiap siklus dikenal 3 masa utama yaitu:
1. Masa menstruasi
yang berlangsung selama 2-8 hari. Pada saat itu endometrium (selaput
rahim) dilepaskan sehingga timbul perdarahan dan hormon-hormon ovarium
berada dalam kadar paling rendah
2. Masa proliferasi
dari berhenti darah menstruasi sampai hari ke-14. Setelah menstruasi
berakhir, dimulailah fase proliferasi dimana terjadi pertumbuhan dari
desidua fungsionalis untuk mempersiapkan rahim untuk perlekatan janin.
Pada fase ini endometrium tumbuh kembali. Antara hari ke-12 sampai 14
dapat terjadi pelepasan sel telur dari indung telur (disebut ovulasi)
3. Masa sekresi.
Masa sekresi adalah masa sesudah terjadinya ovulasi. Hormon progesteron
dikeluarkan dan mempengaruhi pertumbuhan endometrium untuk membuat
kondisi rahim siap untuk implantasi (perlekatan janin ke rahim)
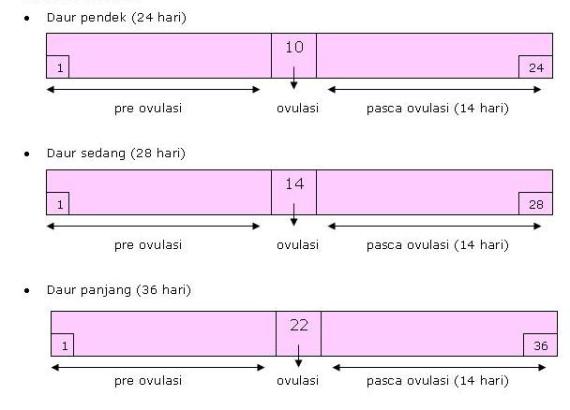
Masa Subur
Masa subur adalah masa dimana akan
terjadi kehamilan pada saat fertilisasi. Pada masa itulah, sel telur
yang dihasilkan berada dalam keadaan siap untuk dibuahi.

Animasi
Langganan:
Postingan (Atom)